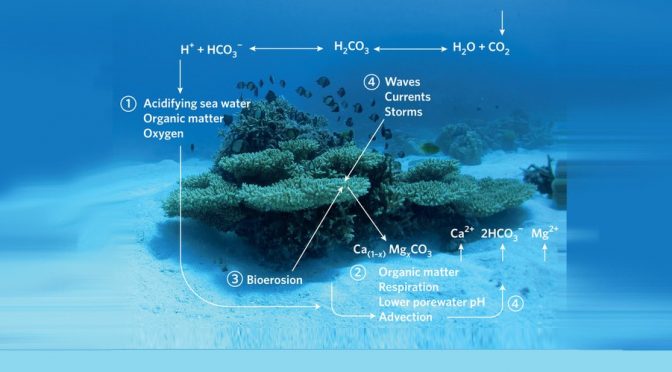
Imagen superior: Modelo conceptual de factores que controlan la disolución de carbonato de calcio en sedimentos (Eyre et al, 2014).
En los cursos básicos de química aprendemos que es posible utilizar ecuaciones para representar procesos y reacciones químicas. Una de las ventajas de las ecuaciones químicas es que podemos sumarlas para representar reacciones más complejas, y poder explicarnos cada uno de los pasos que intervienen en el proceso de transformación. Por ejemplo, la siguiente serie de reacciones (y su adición):

Puede interpretarse como:
El dióxido de carbono de la atmósfera CO2 (g) y del suelo, se disuelve en el agua H2O(l) -líquida bajo condiciones ambientales normales- y al infiltrarse, arrastra al ahora disuelto CO2 (ac) que se hidrata en forma de ácido carbónico H2CO3*, que se disocia para producir ion bicarbonato HCO3–, muy soluble, más un protón solvatado H+ / H3O+ al que llamamos protón “ácido”, altamente reactivo y que reacciona fácilmente con el insoluble carbonato CO32- para producir más bicarbonato. Todas estas reacciones son reversibles. Este proceso permite la disolución del carbonato de calcio de las rocas CaCO3 (s), que al disolverse, a su vez, produce más iones de bicarbonato HCO3– y de calcio Ca2+(ac). Esta reacción muestra también que en una eventual acidificación del océano, como la prevista como consecuencia del cambio climático global, habrá una tendencia a la disolución, ya que el CO2(g) de la atmósfera al disolverse en el agua del océano la vuelve más ácida y reactiva a este material. Paralelamente, esta ecuación química leída en sentido inverso indica el proceso de desgasificación y precipitación de carbonato de calcio, un importante mecanismo en la formación de estalactitas, estalagmitas y otros espeleotemas dentro de las cuevas.
Además, conformado por sus ácidos y bases conjugadas, el dióxido de carbono gaseoso, ácido carbónico, iones bicarbonato y carbonato, todos juntos, constituyen el sistema de carbonatos, que es el más importante regulador de pH en el agua de los océanos y también del agua subterránea de la península de Yucatán.
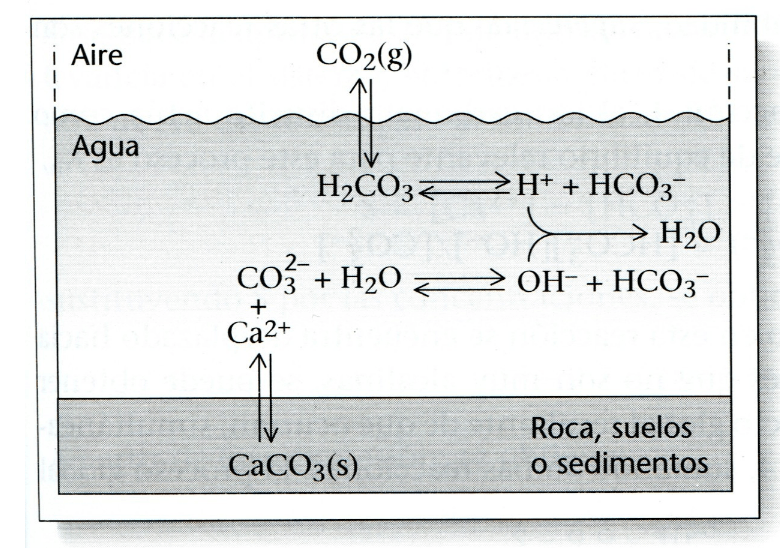
La serie de reacciones que conducen del dióxido de carbono disuelto al carbonato, alcanza rápidamente un equilibrio dinámico, un estado en el que los procesos de avance y retroceso de esta reacción ocurren a velocidades iguales. Agregar ácido aumentará la velocidad de la reacción inversa y de la formación de dióxido de carbono, causando que más dióxido de carbono se difunda fuera de la solución. La adición de una base, por otro lado, aumentará la velocidad de la reacción hacia adelante, causando que se formen más bicarbonato y carbonato. Cualquier presión sobre este sistema provoca un cambio compensatorio en una dirección que restaura el equilibrio. El sistema amortiguador continúa trabajando mientras su concentración sea grande en comparación con la cantidad de ácido o base agregada a la solución.
En el océano, el dióxido de carbono disuelto de la atmósfera está en equilibrio con las concentraciones de ácido carbónico y bicarbonato en el agua de mar. Sin embargo, el aumento de las emisiones antropogénicas de dióxido de carbono ha elevado los niveles de dióxido de carbono en la atmósfera, causando un aumento en el dióxido de carbono disuelto. A medida que aumenta la concentración de dióxido de carbono disuelto, la velocidad de la reacción directa del sistema de amortiguación aumenta hasta que el sistema alcanza un nuevo equilibrio. Esto significa que un aumento en el dióxido de carbono disuelto causa una ligera disminución en el pH. La capacidad de amortiguación del océano, su capacidad para absorber el ácido o la base, es muy grande, pero los cambios globales y graduales de este tipo pueden tener serias ramificaciones para muchos tipos de vida en el océano. Los animales que fabrican sus conchas a partir de carbonato de calcio, por ejemplo, podrían encontrar reducidas sus capacidades para hacer conchas debido a cambios significativos en el equilibrio ácido-base del agua del océano.
En los seres humanos y otros animales, el sistema de amortiguamiento de carbonatos ayuda a mantener un pH constante en el torrente sanguíneo. El pH de la sangre depende de la proporción de dióxido de carbono a bicarbonato.
El dióxido de carbono, un subproducto de la respiración celular, se disuelve en la sangre, donde es captado por los glóbulos rojos y se convierte en ácido carbónico por la anhidrasa carbónica. La mayor parte del ácido carbónico se disocia en bicarbonato e iones de hidrógeno. Fuente: Anatomy & Physiology.
Las concentraciones de ambos componentes son muy grandes en comparación con las concentraciones de ácido agregado a la sangre durante las actividades normales o el ejercicio moderado. Durante el ejercicio intenso, por ejemplo, la respiración rápida ayuda a compensar el aumento de dióxido de carbono en la sangre. Otros mecanismos que ayudan en esta función incluyen la molécula de hemoglobina en los glóbulos rojos, que también ayuda a amortiguar el pH de la sangre.
La imagen del encabezado representa un modelo conceptual de factores que controlan la disolución de carbonato de calcio en sedimentos | Conceptual model of factors controlling CaCO3 sediment dissolution.
Eyre BD, AJ Andersson & T Cyronak (2014) Benthic coral reef calcium carbonate dissolution in an acidifying ocean. Nature Climate Change 4: 969-976.
Entradas relacionadas: